Contexte général
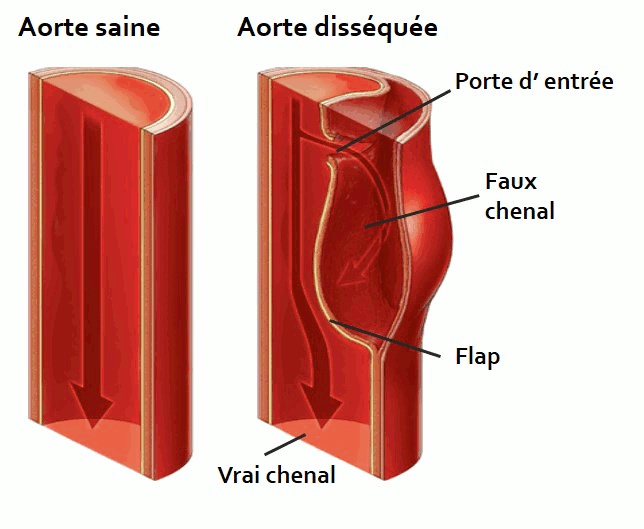
La dissection aortique est une pathologie de l’aorte qui consiste en une déchirure de la paroi vasculaire au niveau de la couche intimale disséquant la paroi. Un faux chenal adjacent à la lumière artérielle est alors créé dans lequel le flux sanguin peut s’écouler. La déchirure est appelée porte d’entrée. Vrai et faux chenaux sont séparés par une partie de la paroi disséquée que l’on appelle flap néointimal (Figure1).Il existe deux types de dissection: les dissections de type A localisées au niveau de l’aorte thoracique ascendante qui peuvent toutefois s’étendre à l’aorte thoracique descendante, et les dissections de type B qui concernent uniquement l’aorte thoracique descendante (figure 2).
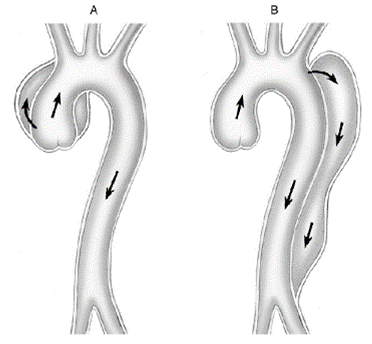
Figure 2: dissections de type A et B.
Pour les dissections aortiques de type A le traitement est chirurgical avec l’implantation d’une prothèse. Pour les type B le traitement interventionnel est réservé aux cas présentant notamment des ruptures, des malperfusions, des douleurs non contrôlées,... Les formes dites non compliquées bénéficient quant à elles d’un traitement médical seul avec une morbi-mortalité faible. Toutefois malgré de bons résultats immédiats suite au traitement médical seul, 20 à 50 % des patients présentent une évolution anévrysmale avec un risque de rupture et de mortalité élevé.Le contexte clinique de ces travaux s’inscrit dans l’identification de patients présentant une dissection aortique résiduelle de type B à risque évolutif défavorable (figure 3).
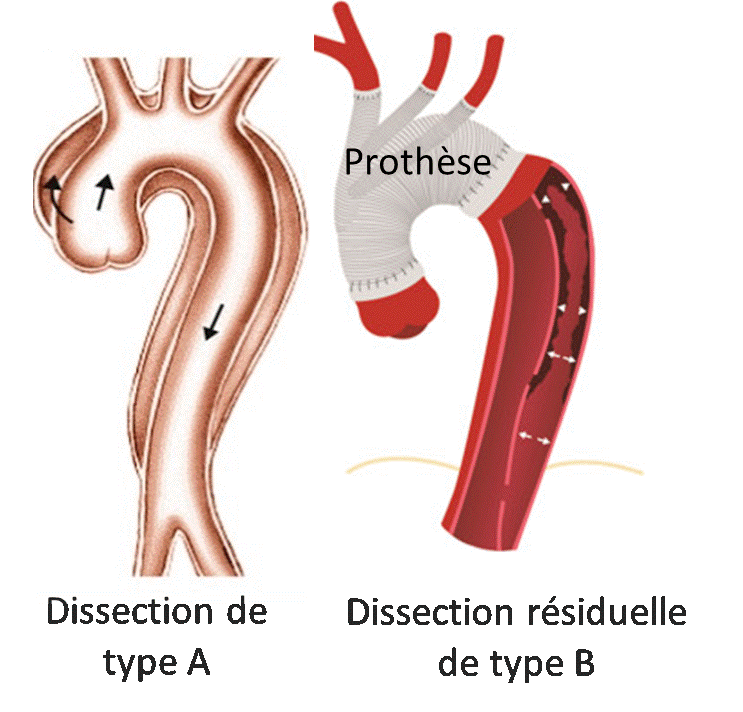
Figure 3: dissection aortique résiduelle de type B.
Ces patients particuliers ont été initialement traités chirurgicalement pour une dissection de type A avec la mise en place d'une prothèse située au niveau de l'aorte ascendante. Les critères permettant d’évaluer une évolution défavorable habituellement utilisés en routine clinique n’étant pas complètement satisfaisants, il s’agit de déterminer au travers de modélisations numériques quelles sont les grandeurs physiques susceptibles d’être corrélées à une évolution défavorable et améliorer ainsi la prise en charge des patients. Outre la mise en œuvre de modélisations numériques intégratives et systémiques (thèse F. Khannous), les originalités de ces travaux résident dans la complémentarité entre modèle numérique et expérimentations in vivo et in vitro de caractérisation mécanique et dans l’approche évolutive de la pathologie. Enfin, ces travaux donnent lieu à des études statistiques de population de patients afin de corréler les résultats obtenus avec différents types de modélisation (thèse M. Gaudry).Modélisations numériques
Grâce à des images médicales (angioscanner) et à des logiciels classiques de traitement et segmentation d’images, les géométries des patients sont reconstruites à différents temps post opératoires de le suivi (Figure 4). 
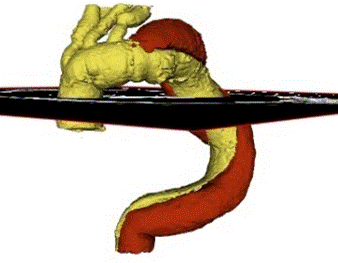
Figure 4: à gauche géométrie du patient immédiatement après la pose de la prothèse (T0). A droite géométrie du patient 14 mois plus tard (T1). En jaune-or : le vrai chenal en rouge le faux.
Vrai et faux chenal sont séparés par le flap néointimal. Hormis la déchirure initiale : porte d’entrée 1, plusieurs autres communications/porte d’entrée peuvent apparaître entre vrai et faux chenal (figure 5). Toutes les entités géométriques sont maillées et 2 temps post opératoires sont retenus afin de réaliser différentes modélisations.
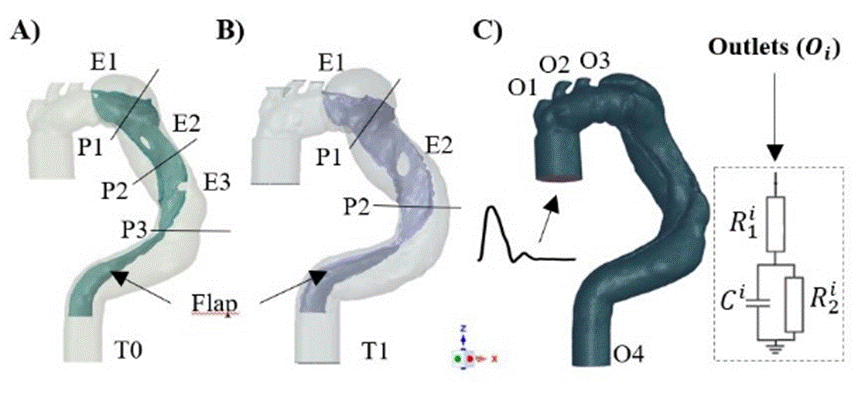
Figure 5: Portes d’entrées (Ei), existant à A) T0 et B) T1. C) Maillage : 1,8 M (T0) d’éléments tétraédriques couplés à 5 couches d’éléments prismatiques couvrant l’épaisseur de la couche limite instationnaire. Schéma des conditions aux limites en sortie.
Un soin particulier est porté aux conditions aux limites. Des modèles Windkessel à 3 éléments sont utilisés à chaque sortie Oi avec des paramètres adaptés aux valeurs de pressions physiologiques en utilisant une méthodologie de couplage : modélisation CFD et optimisation basée sur un algorithme génétique (routines Matlab). Parois artérielles, flap et prothèse sont tout d’abord considérés comme rigides. Un modèle de Carreau-Yasuda est implémenté pour reproduire le comportement rhéofluidifiant du sang. En entrée un profil de vitesse de type Womersely est mis en œuvre à partir de mesures de débit physiologique. La valeur moyenne du nombre de Reynolds est de 1685 ; le régime reste laminaire ; le paramètre de Womersley est égal à 25 et la viscosité dynamique à l’infini de 0.004 Pa.s. L’analyse des images médicales à T1 permet de déterminer l’existence d’une augmentation du volume du faux chenal de 27% en moyenne, d’un élargissement marqué de PE2 : 15X6mm versus 20,6X10,4mm ainsi que la disparation de PE3 due à un faux chenal partiellement thrombosé. L’objectif des premières modélisations mises en œuvre est de prédire l’évolution constatée cliniquement à T1 à partir de l’étude la dynamique des écoulements à T0. Plusieurs grandeurs physiques sont corrélées à des événements cliniques parmi les plus représentatives on citera celles liées au gradient de vitesse comme le frottement pariétal (WSS) ou sa moyenne temporelle (TAWSS) ainsi que celles liées au transport des structures tourbillonnaires qui peuvent se développer dans ces géométries complexes. Par exemple, l’activation, le transport et le relargage d’éléments plaquettaires par la dynamique des écoulements qui se propagent dans l’aorte peuvent participer du développement de matériel thrombotique.
Les résultats obtenus à partir des simulations numériques à T0 font notamment apparaître
(1) des écoulements sous forme de jet au niveau des portes d’entrées induisant des zones à forts gradients de vitesse pouvant favorisées l’activation d’éléments plaquettaires ainsi que la création de structures tourbillonnaires lors de la phase de décélération de l’écoulement. (cf vidéo ci dessous)
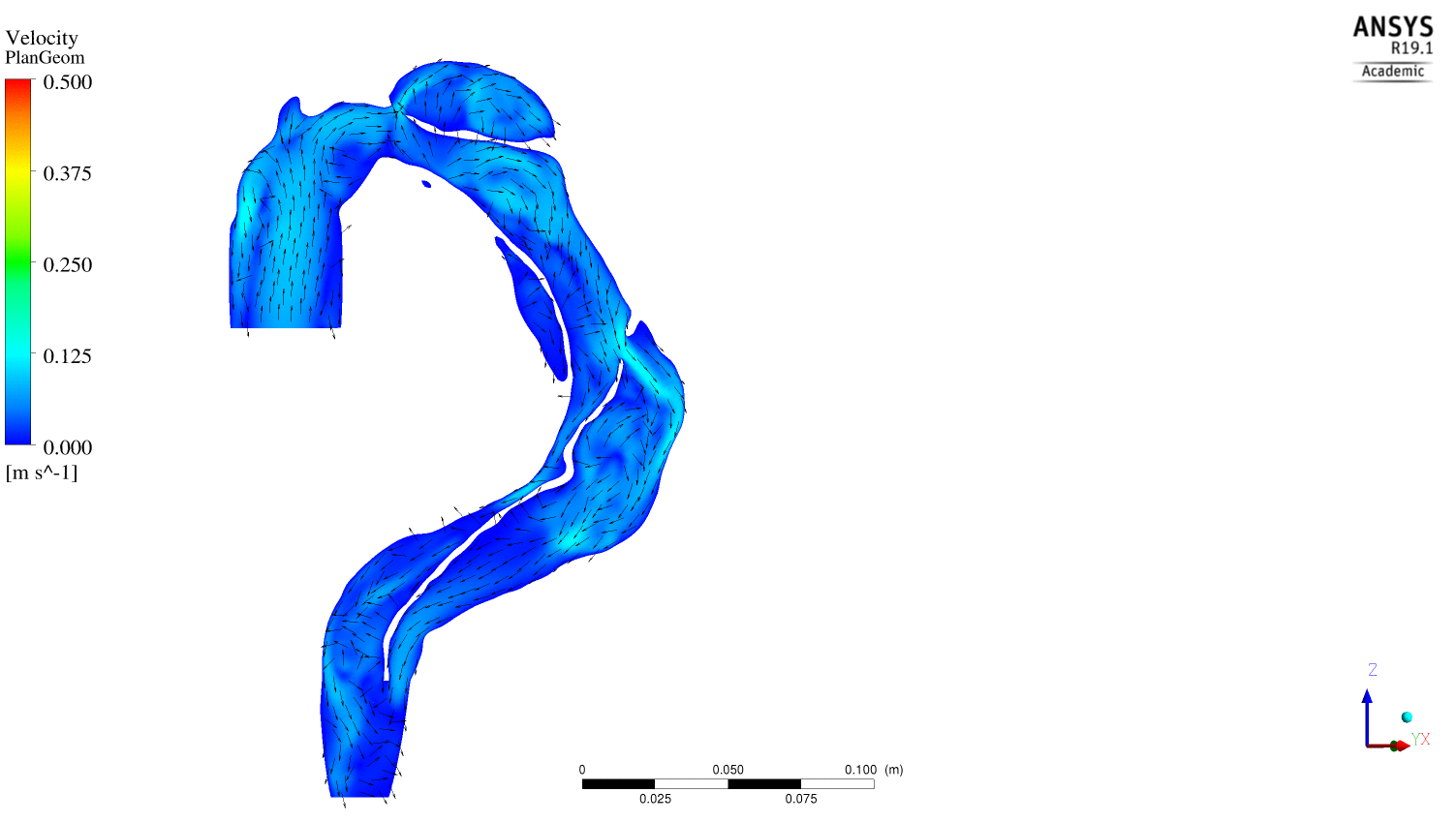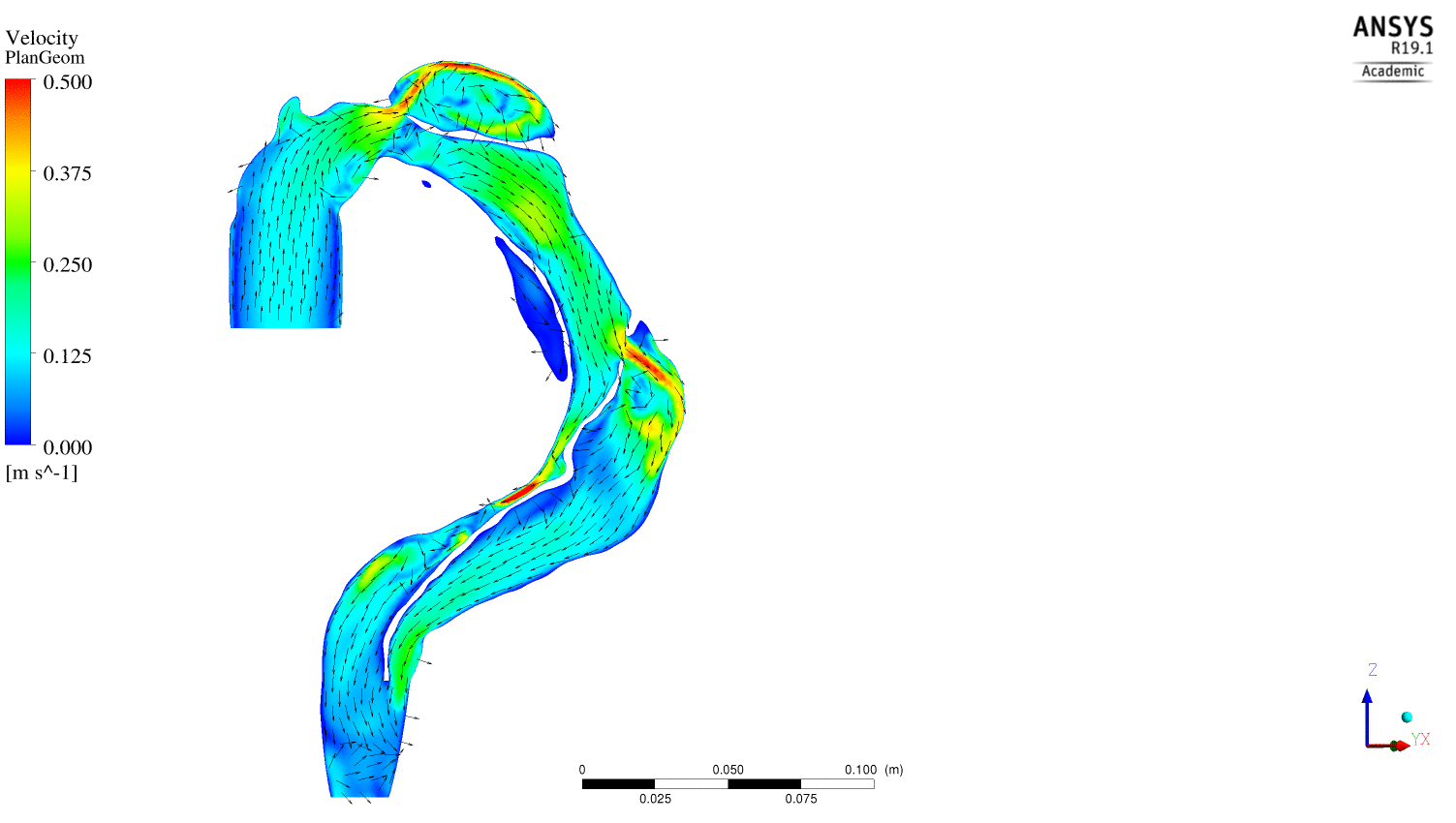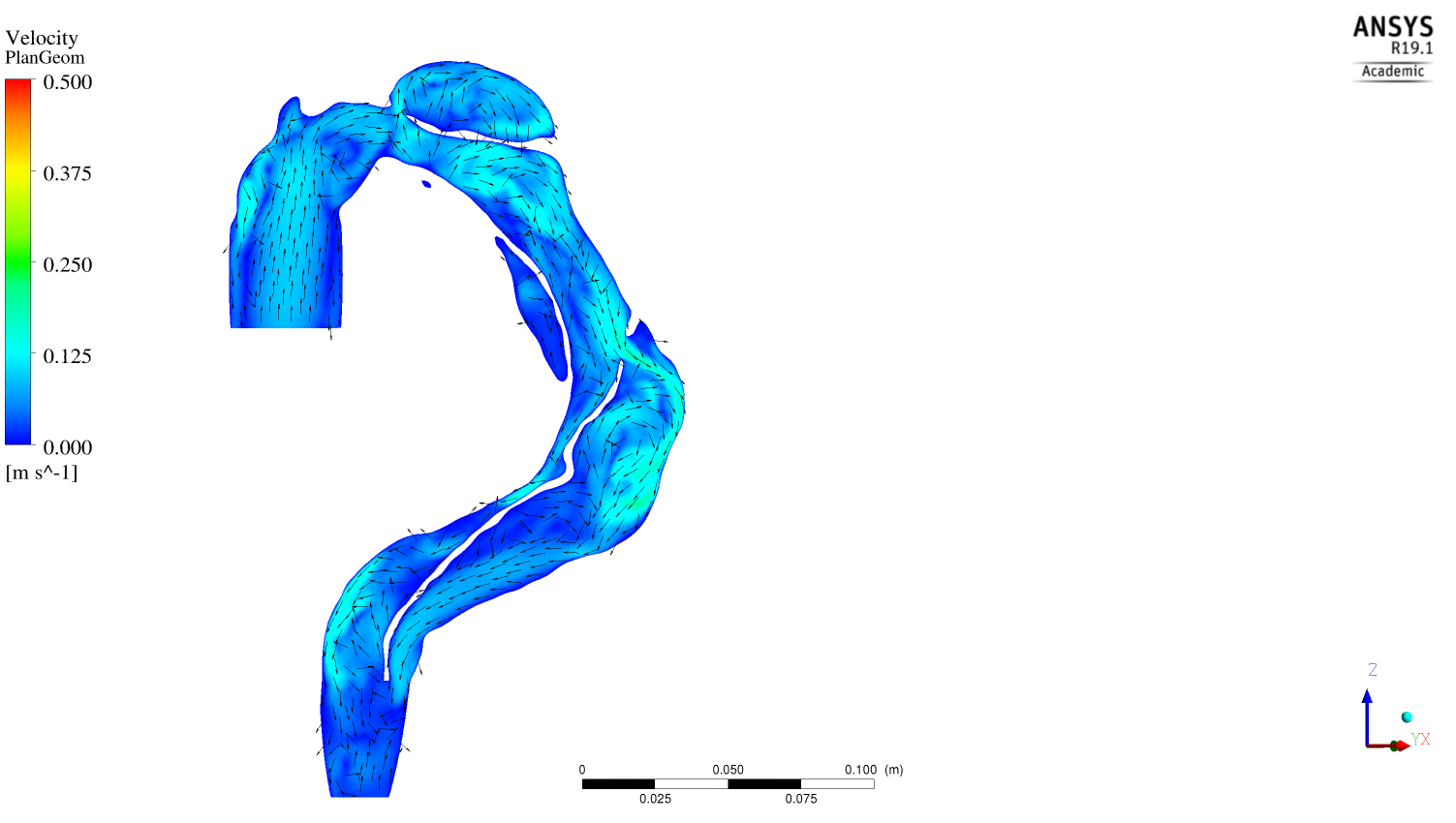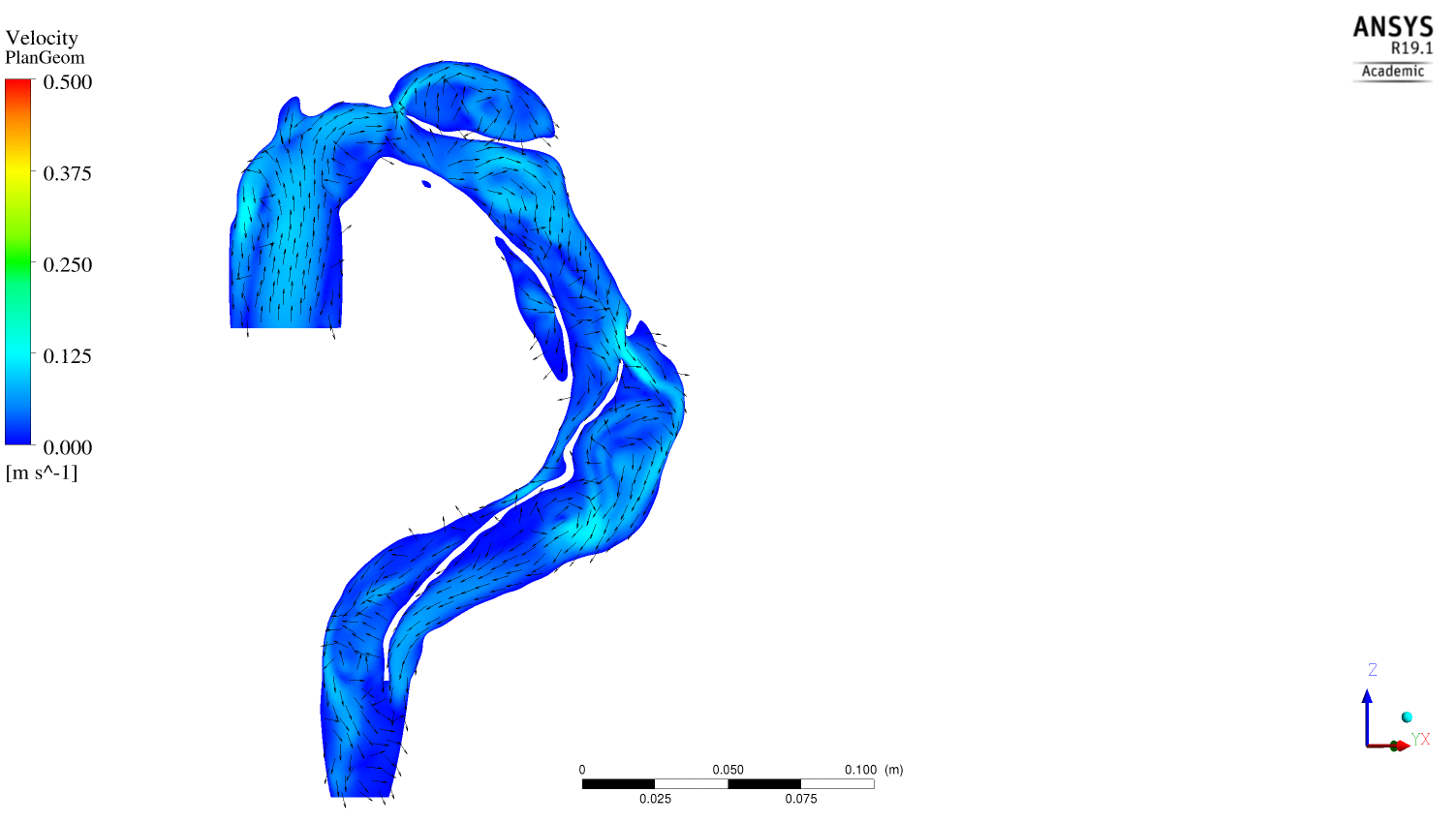
Evolution au cours du cycle cardiaque des vecteurs vitesses dans un plan parallèle à l'écoulement
(2) des zones de recirculation en aval des orifices impliquées dans un accroissement du temps de résidence des particules ainsi que dans l’existence de zones à faibles gradients de vitesses ; deux événements qui sont associés au développement de thrombus, et(3) des structures tourbillonnaires, mis en exergue par les iso contours de 2 dont la propagation et la dislocation participent respectivement du transport et du relargage d’éléments plaquettaires
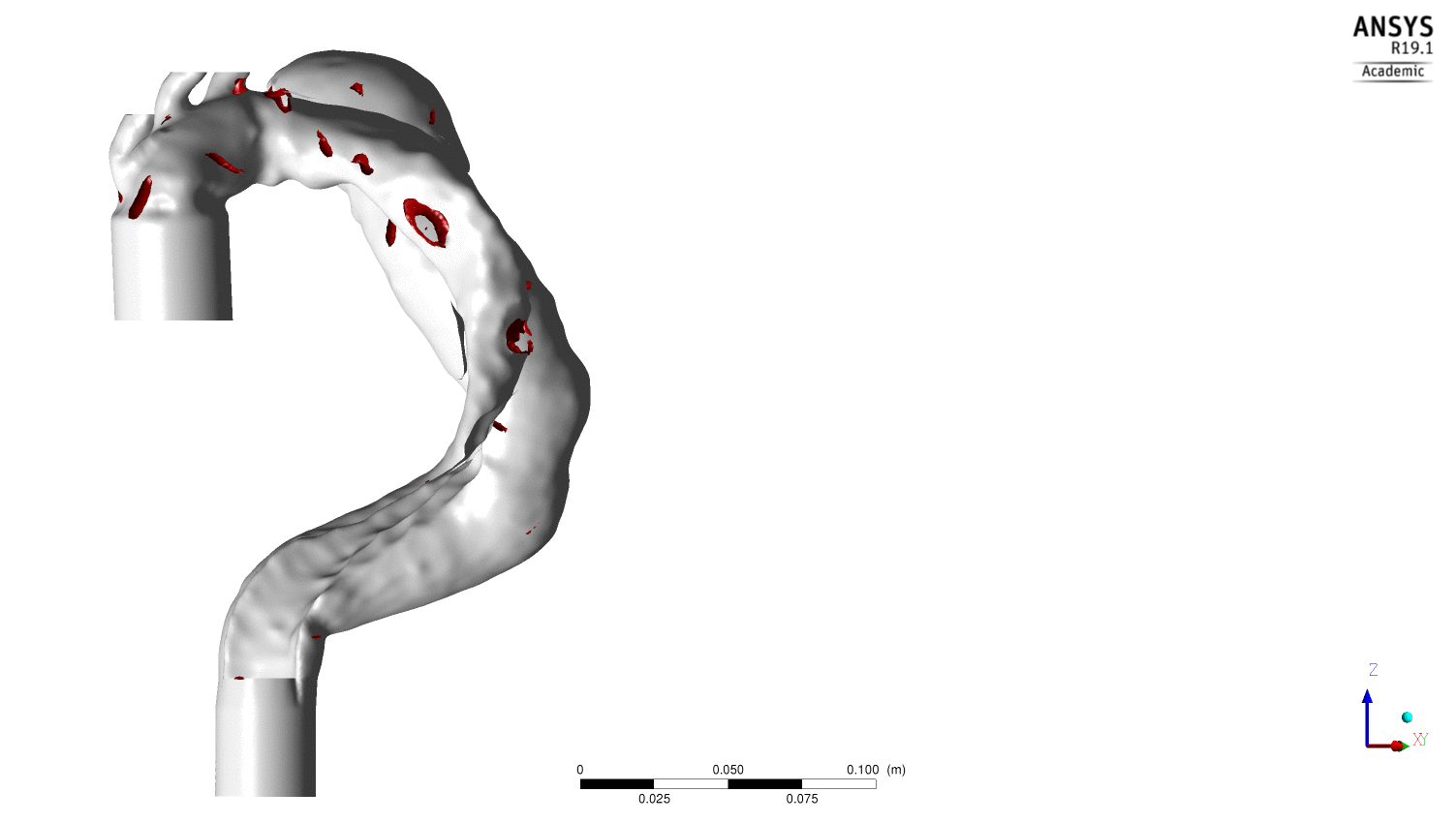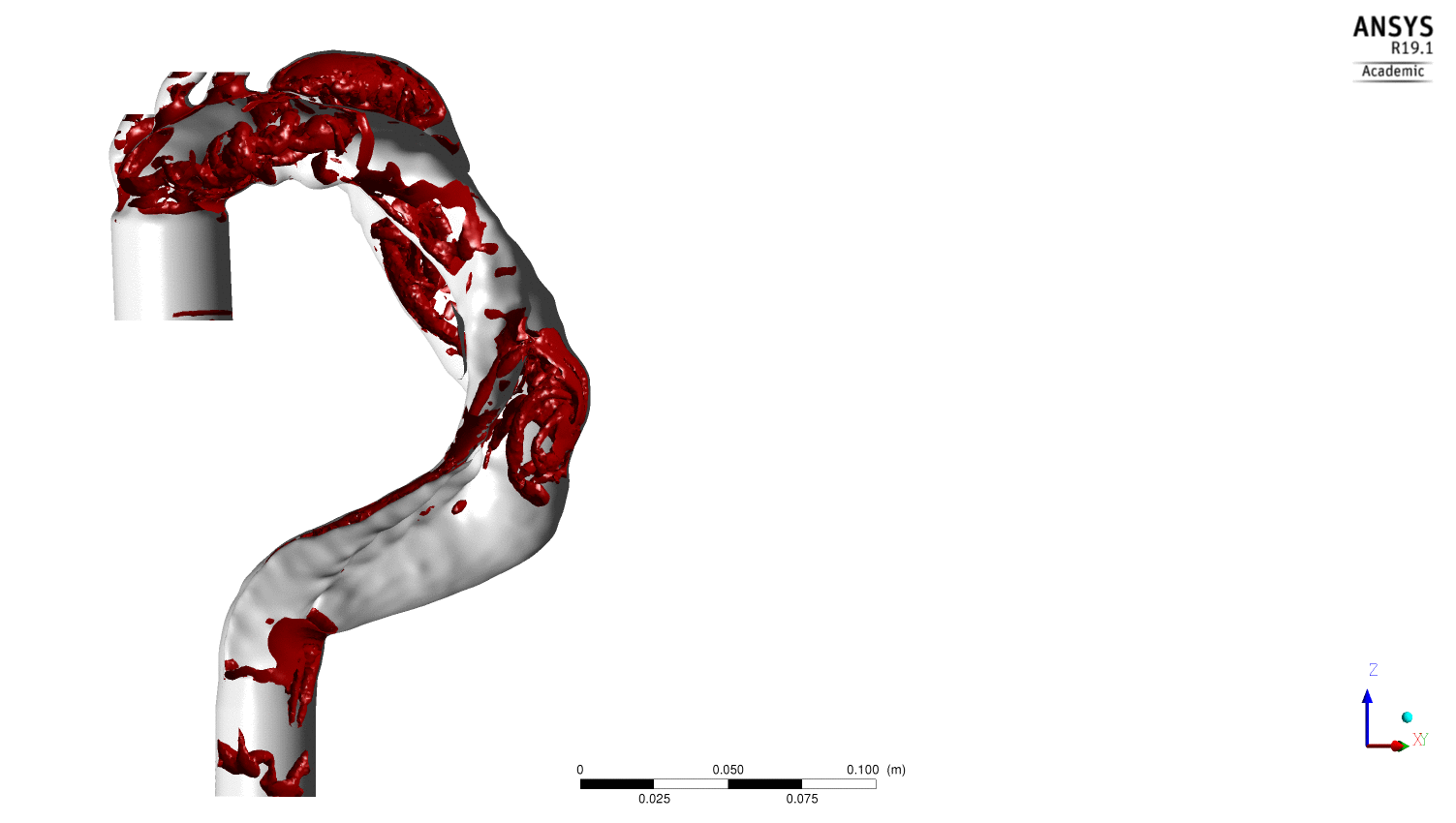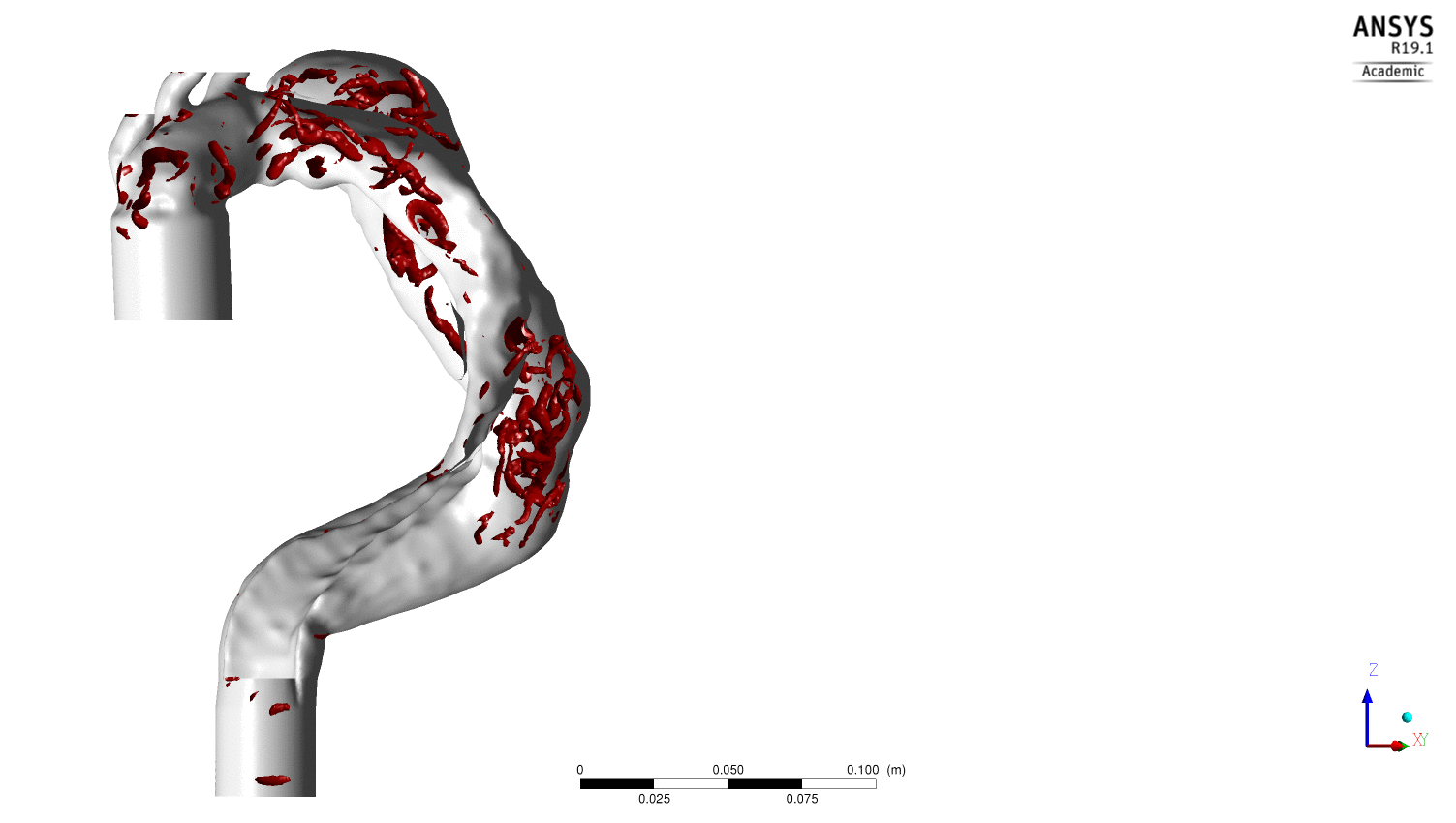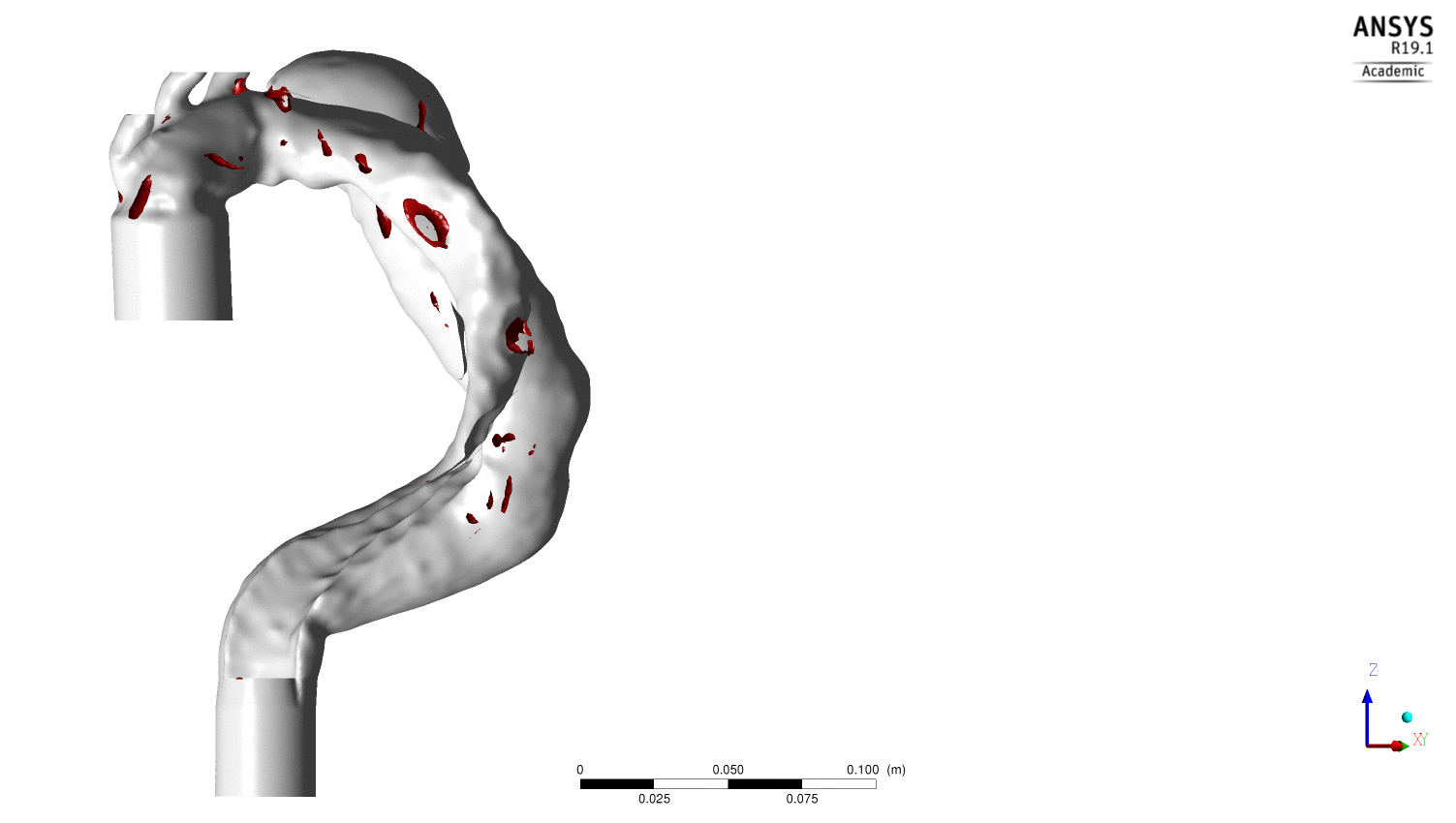
Evolution au cours du cycle cardiaque des structures tourbillonnaires
LA figure 6 permet de montrer l'association entre cartographies de WSS, dynamique des structures tourbillonnaires et formation de thrombus.
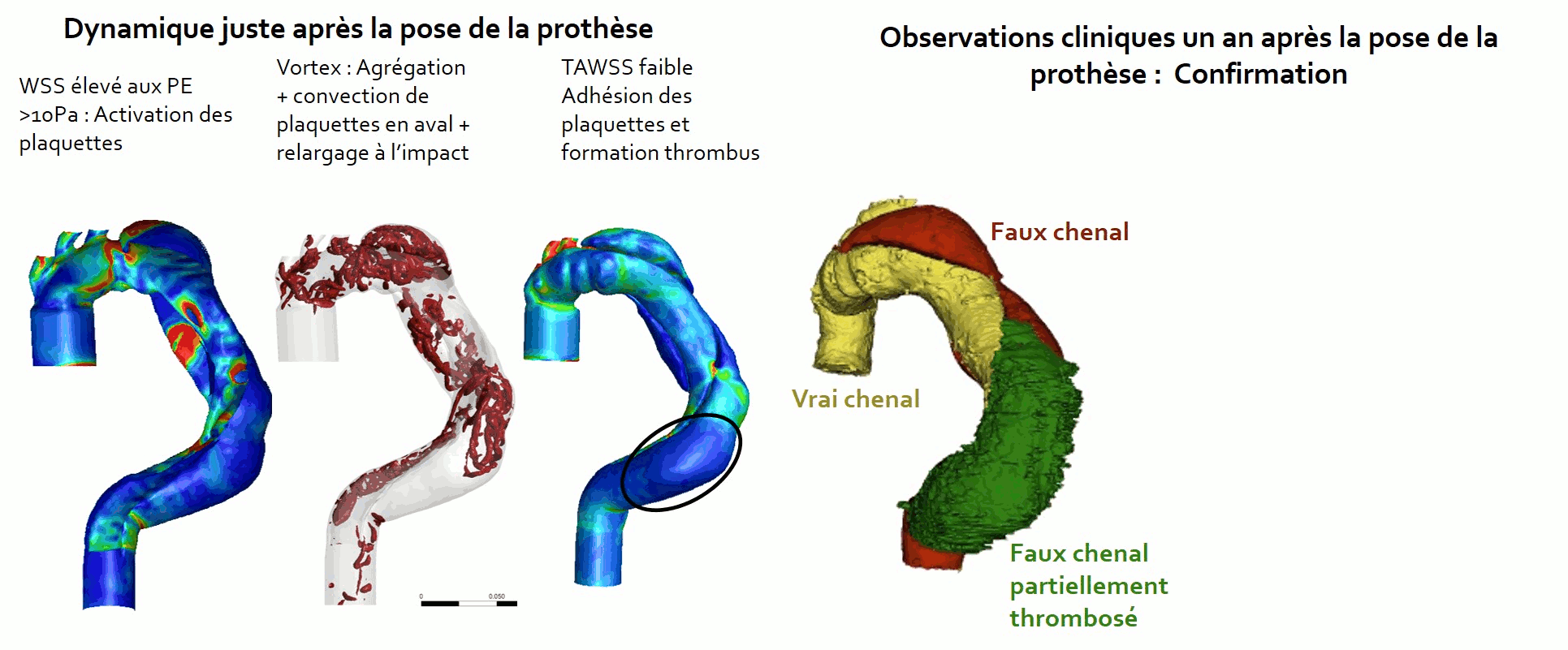
Figure 6: Formation de thrombus.
Khannous, F., Guivier-Curien, C., Gaudry, M.,Piquet, Ph., Deplano, V. Residual type B aortic dissection FSI modeling. Computer Methods in Biomechanics and Biomedical Engineering, 23(1), 153-155.
Khannous, F., Guivier-Curien C., Gaudry, M., Piquet Ph., Deplano, V. Numerical modeling of residual type B aortic dissection: longitudinal analysis of favorable and unfavorable evolution. In revision in Medical & Biological Engineering & Computing, MBEC-D-21-00262, March 2021